

发布时间:2020-05-06 浏览次数:8530
近日,深圳格拉布斯研究院在均相催化领域发表了一项重要研究成果。双聘教授刘心元课题组在Cell·Press细胞出版社旗下期刊Chem上报道了使用本课题组发展的铜/金鸡纳碱磺酰胺催化体系来实现自由基引发的末端烯烃和内烯烃的不对称氧-砜基化反应的重要研究成果。

(来源:Chem)
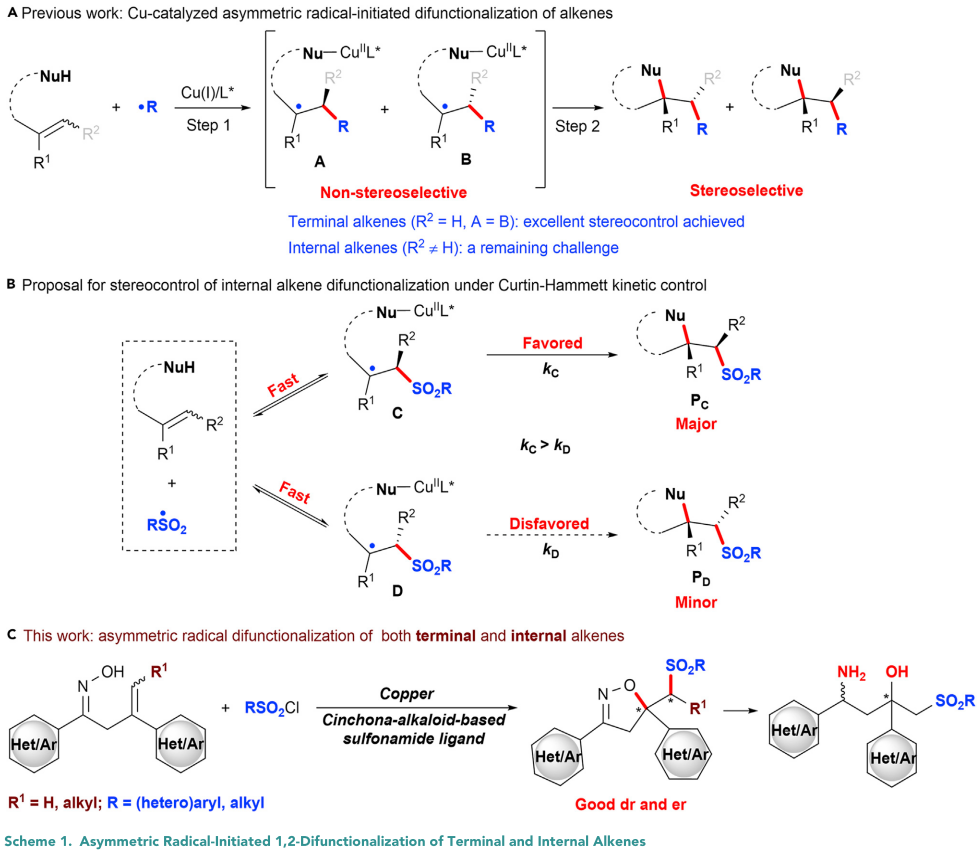
过渡金属催化的烯烃不对称双官能团化可以快速构建两个邻近的碳-碳和/或碳-杂原子化学键和立体中心,被认为是一种制备手性复杂有机分子的强有力的手段。近年来,铜催化的自由基引发的烯烃不对称双官能团化的研究取得了令人瞩目的进展。在此领域,Buchwald和刘国生课题组等分别报道了利用铜/手性双噁唑啉催化体系实现一系列对映选择性的烯烃双官能团化反应(Acc. Chem. Res. 2018, 51, 2036–2046.)。同期,刘心元课题组开发了铜/手性阴离子配体催化体系用于多种不对称转化(Acc. Chem. Res. 2020, 53, 170–181; Nat. Chem. 2019, 11, 1158; Nat. Catal. 2020, 3, 401; Nat. Catal. 2020, DOI: 10.1038/s41929-020-0460-y; et al)。然而,这些方法通常局限于末端烯烃,而使用内烯烃通过C=C双键同时产生两个相邻的立体中心已被证明是非常困难的。现有报道证明第一步自由基(R•)对内烯烃的加成会非选择性的生成中间体A和B,从而难以实现立体化学的控制(Scheme 1A,step 1)。
已有报道证明砜基自由基(RSO2•)和烯烃的加成是快速和可逆的过程。作者尝试通过两种初始非对映体C和D之间的快速平衡,从而符合Curtin-Hammett原理(Scheme 1B)。后续的决定反应速率的烷基自由基的不对称官能化会生成所需产物(如Pc),从而同时实现反应的对映选择性和非对映选择性的良好控制。相关研究成果发表在Chem上(DOI: 10.1016/j.chempr.2020.03.024)。
(来源:Chem)
作者首先探究1a和TsCl在不同铜盐和不同的金鸡纳碱磺酰胺配体存在下的反应情况(Table 1)。此外,还加入了Ag2CO3来淬灭原位生成的HCl。通过一系列筛选,作者发现使用Cu(OAc)2和配体L1在4 Å分子筛存在下,以CHCl3为溶剂,以Ag2CO3和质子海绵为添加剂,可以得到最优的反应结果。

(来源:Chem)
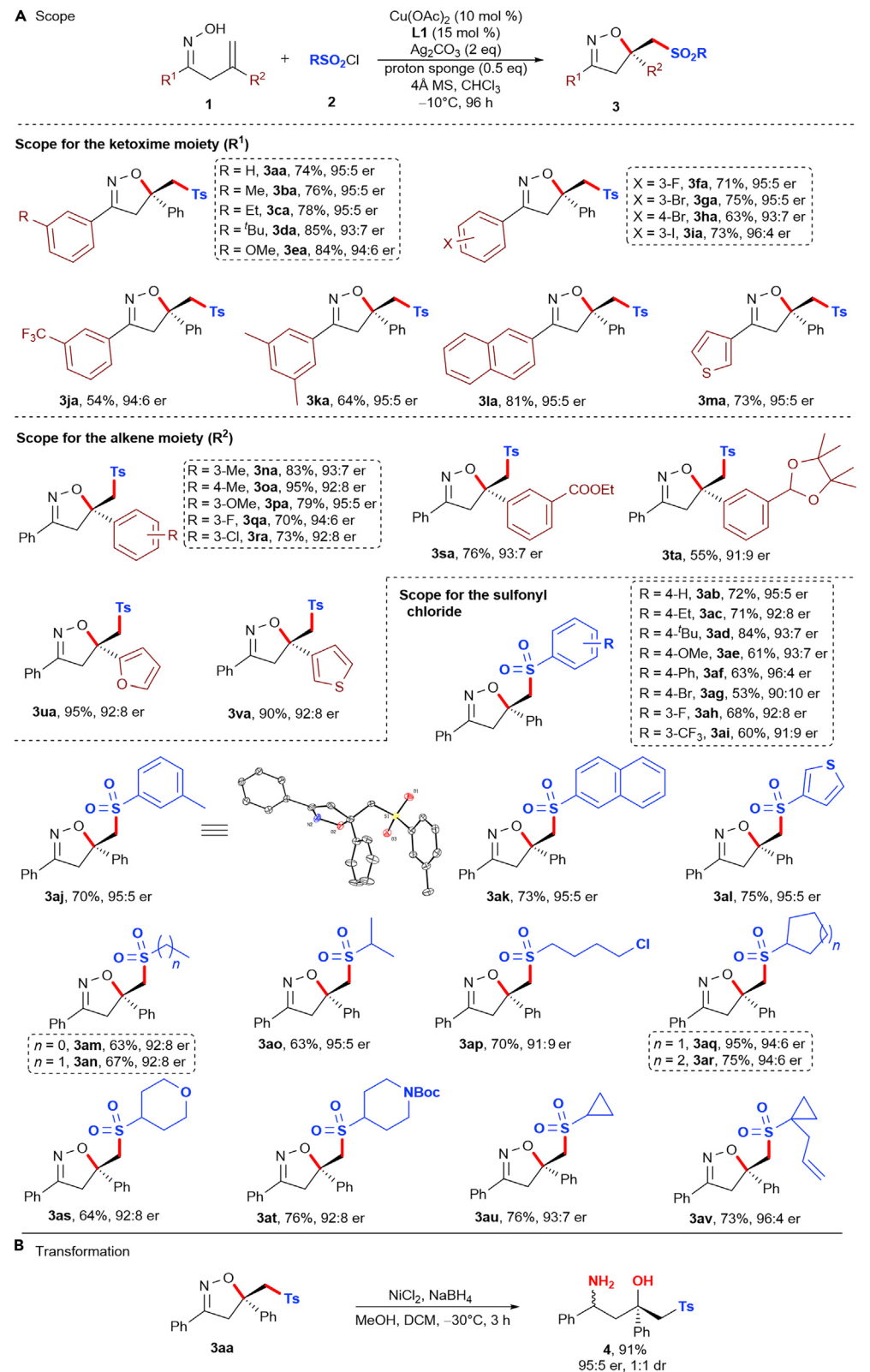
在确定了最佳反应条件后,作者接下来研究了烯基酮肟的底物范围(Figure 1A)。在苯环的不同位置引入供电子或吸电子取代基均能与反应相容。此外,含萘环、噻吩的R1基团也能被耐受。对于烯烃部分的R2基团,在间位或对位上有一系列供电子或吸电子官能团的苯环可与反应相容。呋喃和噻吩基取代的烯烃也可用于反应。
接下来,作者考察了磺酰氯的底物范围,发现一系列带有供电子基团或吸电子基团以及萘的芳基磺酰氯均有好的反应效果。噻吩磺酰氯也能被耐受。并且,一系列开链的烷基磺酰氯和不同的环以及含O或N的杂环烷基磺酰氯都能用于该反应。环丙烷也能被轻易植入。产物中的异噁唑啉可以很容易的裂解成氨基醇(Figure 1B),该单元在许多药物和生物活性分子中广泛存在。

(来源:Chem)
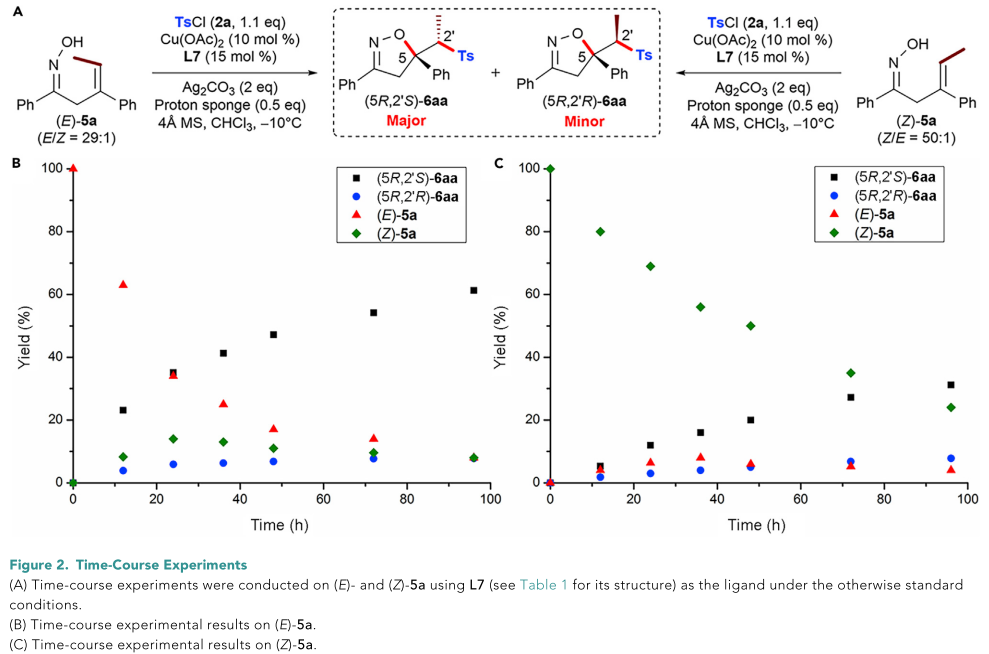
接下来,作者在标准条件下对内烯烃底物(E )-和(Z )-5a分别进行了时间-进程实验(Figure 2)。反应开始时出现了明显的E-Z异构化,表明存在文献所报道的砜基自由基对烯烃的快速可逆加成。并且,(E )-或(Z )-5a都生成具有相同绝对构型的产物(5R,2’S)-6aa。这些结果有力的支持了(E )-或(Z )-5a的反应涉及到具有相同反应速率和决定立体选择性的C-O键形成的步骤。因此,该反应可能符合Curtin-Hammett原理。
(来源:Chem)
作者以(E)-5a为模板底物对反应条件进行了进一步优化,确定L8为最优配体。以内烯烃为底物的反应能很好的耐受酮肟、烯烃和磺酰基团上的一系列不同取代基(Scheme 2)。此外,环内烯烃也是该反应可行的底物。

(来源:Chem)
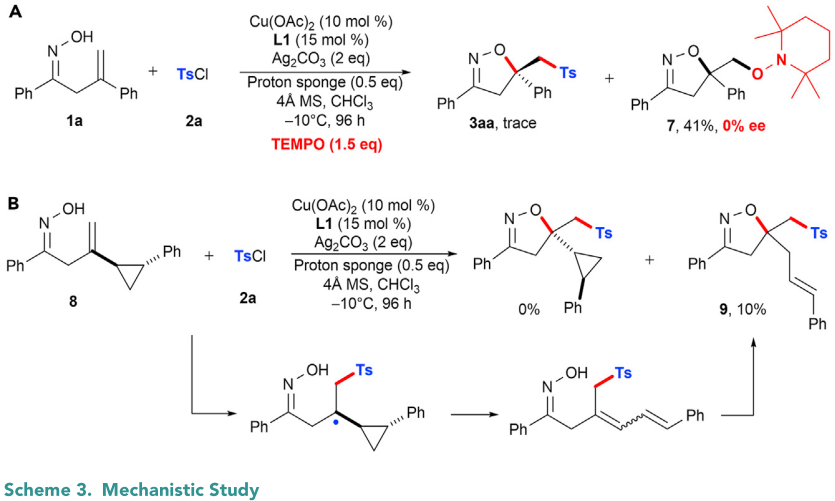
为了进一步了解反应机理,作者进行了对照实验。首先,加入自由基抑制剂TEMPO明显抑制了3aa的生成(Scheme 3A)。另一个产物7能以41%的产率生成,推测是亚胺氧自由基生成后发生5-exo-trig环化,然后被TEMPO捕获得到。产物7是外消旋体,作者由此推测亚胺氧自由基可能不是生成3aa和7的中间体。探针8在标准反应条件下没有生成任何氧-砜基化产物,却得到了10%产率的9,作者推测可能经历了串联的自由基加成、环丙烷开环和氢烷氧基化过程(Scheme 3B)。以上这些实验结果表明,砜基自由基很可能原位生成,进一步加成烯烃,随后C-O键形成得到最终产物。
(来源:Chem)
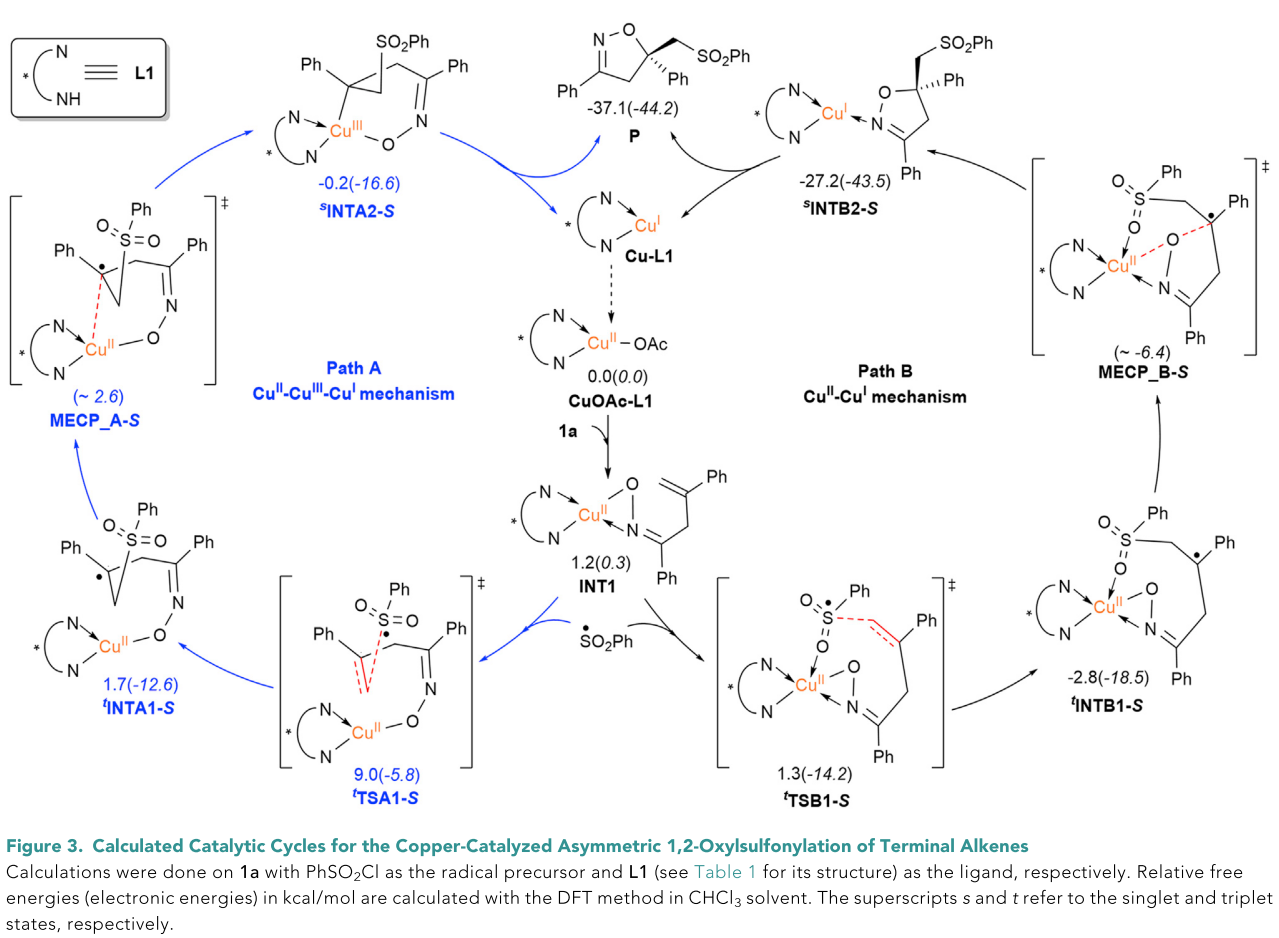
为了更深入的了解反应机理,作者与香港中文大学(深圳)的成贵娟课题组以及北京大学深圳研究生院的张欣豪课题组合作进行了理论计算。通过实验观察和密度泛函理论(DFT)计算,作者推测出两种可能的反应路径,如CuII-CuIII-CuI和CuII-CuI机理(Figure 3中的反应路径A和B)。计算结果表明作为决速步的MECP_B-S的电子能量较低(和MECP_A-S差别9.0 kcal/mol),说明CuII-CuI(路径B)可能更有利。
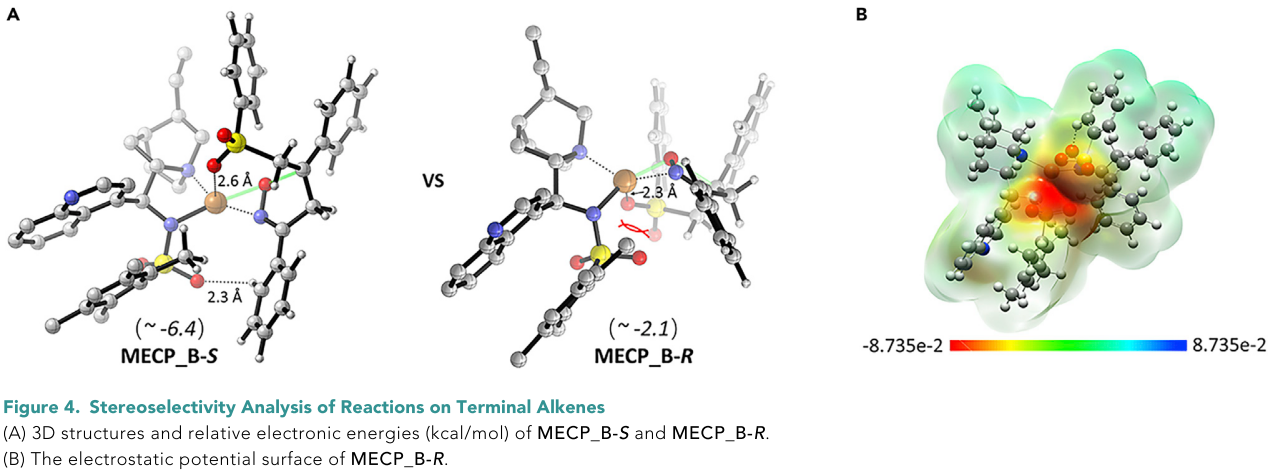
同时,计算结果表明自由基加成步骤的正向和逆向反应能垒确实很低(路径B: 0.1 kcal/mol, INT1→tTSB1-S; 4.1 kcal/mol, tINTB1-S→tTSB1-S),这与实验观察结果一致,说明这一步确实可能是一个快速且可逆的过程。因此,C-O键的形成决定反应的对映选择性。最终的计算结果表明,以末端烯烃为底物的氧-砜基化反应的对映选择性来源于底物与配体之间的氢键相互作用和静电斥力(Figure 4)。
(来源:Chem)
(来源:Chem)
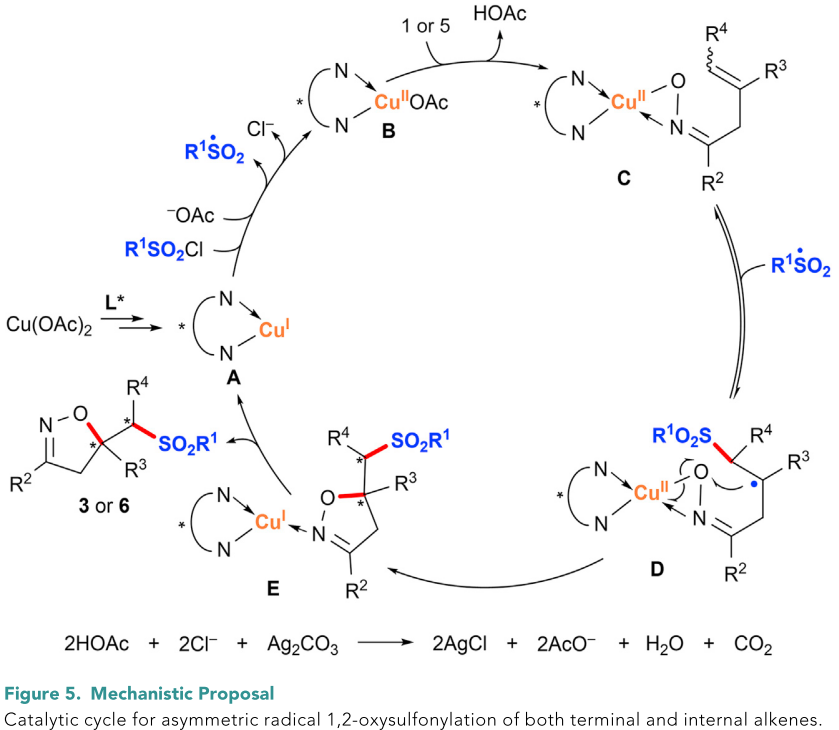
在上述实验和计算研究的基础上,作者提出了可能的反应催化循环(Figure 5)。原位形成的具有强还原性的双螯合CuI复合物A首先与磺酰氯进行单电子转移,生成CuII复合物B和砜基自由基。B与底物1或5反应,通过去质子化生成中间体C。砜基自由基对中间体C进行可逆进攻,生成烷基自由基D。随后发生的分子内自由基取代反应生成CuI-产物复合物E,最终水解得到产物3或6并重新生成CuI复合物A。反应中产生的化学计量的酸和氯的副产物被碳酸银清除掉。
(来源:Chem)
综上所述,作者以铜(I)-金鸡纳碱磺酰胺复合物为具有强单电子还原能力的催化剂,发展了一种通用的、高效的自由基引发的烯烃的不对称氧-砜基化反应。这种方法在温和的条件下表现出宽广的底物兼容性。实验和计算研究表明,该反应符合Curtin-Hammett原理,可能存在具有高效立体识别性的CuII-CuI催化循环。产物可以被进一步转化为有价值的有机砌块。作者期望本策略能够在极具挑战性的自由基引发的内烯烃的不对称双官能化研究领域中,为同时精确控制反应的非对映选择性和对映选择性的探索打开一扇新的大门。
该成果发表在Cell·Press细胞出版社旗下期刊Chem上,文章第一作者是深圳格拉布斯研究院的高级研究学者—李锡涛博士,南科大硕士研究生吕铃和香港中文大学(深圳)的博士后—王婷博士为同等贡献作者,南方科技大学深圳格拉布斯研究院和化学系是该项研究的第一通讯单位,刘心元教授为通讯作者,共同通讯作者为香港中文大学(深圳)的成贵娟助理教授。北京大学深圳研究生院的张欣豪副教授也为本工作的完成提供了重要帮助。
今年以来(2020年1月至4月),深圳格拉布斯研究院已发表论文48篇,其中一区高水平论文(JCR分区)31篇,科研成果十分抢眼。目前,研究院有机合成平台已基本建成,全自动高通量催化剂制备及筛选设备已完成安装和主体设备调试,研究院将在高效科研平台的驱动下进入快速发展时期。
该研究得到了国家自然科学基金委员会、教育部特聘专家、广东省重点实验室、深圳市科创委、深圳市诺贝尔奖科学家实验室、中国博士后科学基金等项目的大力资助。
文章链接:https://www.cell.com/chem/fulltext/S2451-9294(20)30137-6