

发布时间:2023-03-28 浏览次数:5818
过渡金属催化的亲电性的有机卤化物与亲核试剂的交叉偶联反应已经发展成为应用最为广泛的构建碳–碳和碳–杂(p区元素)键的方法之一,在现代有机合成中占有重要的地位(图A)。然而,通过过渡金属催化的杂原子和杂原子相互交叉偶联反应构建杂–杂(p区元素)键的报道则相对较少,而不对称反应更是罕见。实现该类反应最大的挑战在于杂–杂键成键时最后还原消除的步骤十分困难(图B)。此外,杂–杂(p区元素)键化合物是有机化学中是一类非常重要的化合物,更是天然产物、活性药物分子中不可或缺的合成砌块,也是构建新配体、新材料的重要组成成分。因此实现过渡金属催化的杂–杂偶联反应,尤其是实现不对称杂–杂偶联反应具有重要的学术意义。
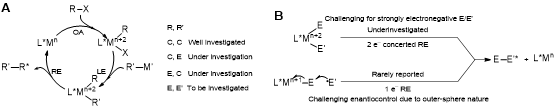
图(A)过渡金属催化的对映选择性交叉偶联反应;(B)杂–杂交叉偶联反应中对映选择性还原消除的挑战
讲席教授刘心元团队设想通过单电子还原消除的方式解决杂–杂键难以发生两电子还原消除的问题,同时通过手性配体调控来实现不对称杂–杂偶联反应。基于此设想,团队使用磺酰氯作为杂原子亲电试剂,在一价铜的还原下产生磺酰基自由基中间体和二价铜,前手性或内消旋二醇与产生的二价铜进行配体交换,最后磺酰基自由基与二价铜中间体进行单电子还原消除,从而实现了铜催化的不对称自由基杂原子硫–氧偶联反应(图C)。该反应的底物适用范围十分宽泛,内消旋1,2-二醇,前手性1,3-二醇,前手性2-氨基-1,3-二醇,前手性1,2,3-三醇,部分羟基被保护的内消旋四醇、五醇、六醇等都可以很好的进行去对称化不对称自由基磺酰基化反应(图D)。更重要的是,利用此策略便可以实现大宗化工原料甘油的不对称转化,实现高附加值手性C3合成子的构建(图E)。除此之外,利用该反应作为关键步骤,还可以实现肌醇的高对映选择性4,6-位去对称化,为手性肌醇-4(or 6)-磷酸酯的合成提供了新的策略(图F)。该反应的实现为挑战性的非环全碳季碳手性中心以及资源分子高效不对称转化提供了多样化便捷的合成平台,为不对称自由基杂–杂偶联反应提供了新策略和新思路。
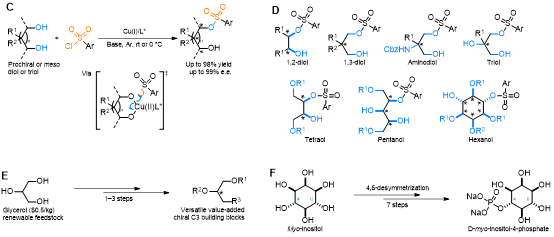
(C)催化的不对称自由基杂原子硫–氧偶联反应;(D)底物适用范围;(E)大宗化工原料甘油高效转化手性C3合成子;(F)肌醇对映选择性4,6-去对称化
南方科技大学化学系研究助理教授程永峰为论文第一作者,刘心元讲席教授为第一通讯作者。南方科技大学为论文通讯单位。合作作者包括南方科技大学18级博士生鱼章龙,19级博士生田宇,浙江大学17级博士生刘吉人;合作通讯作者包括浙江大学化学系博士生导师洪鑫,南方科技大学前沿与交叉科学研究院研究副教授顾强帅。感谢国家自然科学基金项目、广东省广创团队、深圳市科创委和南科大等经费资助和大力支持。