

发布时间:2024-08-02 浏览次数:5306
有机锗化合物由于具有独特的化学、物理及生物性质,在有机合成、药物化学和材料科学领域具有广泛的潜在应用价值。然而,相比于其他碳族元素,手性有机锗化学的研究和发展长期以来相对缓慢和滞后,目前已知的光学纯有机锗化合物仍然十分稀少。作为碳和硅的生物电子等排体,手性有机锗化合物在药物研究中表现出独特的应用前景。此外,其在不对称氢原子转移反应中可以作为有机小分子催化剂。因此,亟需发展高效的不对称催化方法合成手性有机锗化合物。但到目前为止,通过还原偶联反应、卡宾插入反应、氢硼化反应及[2+2+2]环加成反应等方法,只有非常少的几例报道实现了碳中心手性(3例)或锗中心手性(2例)有机锗化合物的催化不对称合成(图1a, 1b)。
Cu催化不对称氢锗化反应构筑碳、锗中心手性锗烷
从合成的角度看,对烯烃或炔烃的氢锗化反应无疑是合成有机锗化合物最直接、最原子经济性的方法。尽管目前通过自由基诱导、路易酸催化或过渡金属催化能实现此类氢锗化反应,但通过催化不对称氢锗化反应实现手性有机锗化合物的合成仍十分具有挑战性(图1c)。基于课题组前期的工作(ACS Catal., 2022, 12, 14592–14600),双聘教授何川课题组报道了利用手性配体控制原位生成[Cu-Ge]中间体的方法,高效实现了Cu催化不对称氢锗化反应合成碳中心及锗中心手性有机锗化合物。该反应底物适用范围广,具有良好的产率及良好至优秀的对映选择性。实验结果表明:配体的选择至关重要,合适的配体决定了[Cu-Ge]中间体或[Cu-H]中间体的化学选择性,并控制了生成碳中心或锗中心手性的立体选择性(图1d, 1e)。

图1 催化不对称氢锗化反应(来源:CCS Chemistry)
通过对反应机理的DFT计算研究表明:[Cu/ligand-Ge] 物种是该Cu催化不对称氢锗化反应的关键中间体,而烯烃的亲核加成反应是立体控制的决定步骤(图2a, 2b)。基于此,作者提出了该反应的可能机理(图2c):包含连续的配位反应、去质子反应、亲核加成反应及质子化反应。最后,作者也对对映选择性起源进行了研究,结果表明:TS2R的吉布斯自由能比TS2S高4.0 kcal/mol,TS2R的形变能比TS2S高6.8 kcal/mol,产物的构型为S,与得到的晶体构型一致(图2d)。
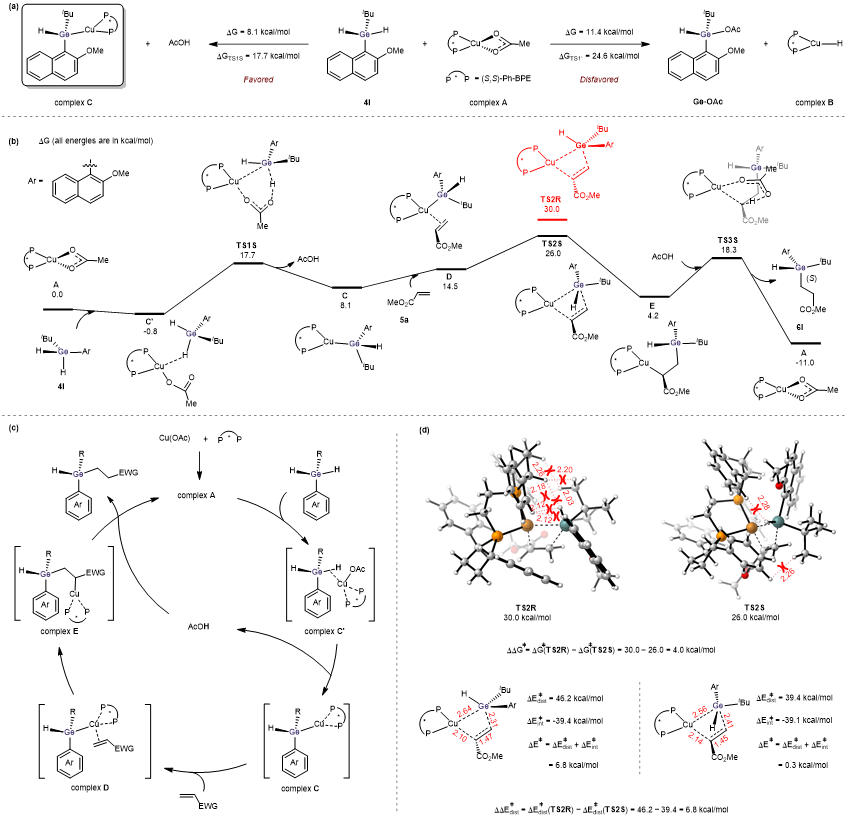
图2 DFT计算研究及可能的反应机理(来源:CCS Chemistry)